2018年招收攻读硕士学位研究生入学考试试题
********************************************************************************************
招生专业及代码:080501 材料物理与化学、080502材料学、080503 材料加工工程、0805Z1 生物材料、085204材料工程(专业学位)
考试科目级代码:821材料综合
考生请注意: 《材料综合》满分150分,考卷包括A《基础化学》、B《材料科学基础》两项内容。请根据自己的专业背景和未来拟从事的专业研究方向,只能从A、B两项中任选其中一项作答,如果两项都做,仅记A项的成绩。
A、基础化学
|
考生注意:所有答案必须写在答题纸(卷)上,写在本试题上一律不给分。 |
|
一、 是非题(判断下列叙述是否正确,正确的在括号中画√,错误的画×)(共10小题,每小题1分,共计10分) ( )1.氢电极的电极电位是0.0000 V。 ( )2.极性分子中的化学键是极性键,非极性分子中的化学键是非极性键。 ( )3.25 ℃时,0.10 mol·L-1的H[Al(OH)4]溶液中OH-浓度是H+浓度的4倍。 ( )4.分子间形成氢键的物质, 沸点和熔点会降低。 ( )5.HAC溶液和NaOH溶液混合可以配成缓冲溶液,条件是NaOH比HAC的物质的量适度过量。 ( )6.吸光度表示物质对光吸收的程度,物质浓度越大,吸光度一定越大。 ( )7.当溶液中无其它干扰离子存在时,应选择波长为λmax的光作入射光进行分光光度法测定。 ( )8.在配合滴定中,金属离子与滴定剂EDTA一般是以1:1配合。 ( )9.当溶液中H+浓度与OH-浓度相等时,酸碱指示剂显示其中间色。 ( )10.Na2CO3溶液中H2CO3的浓度近似等于Kb2 。 |
|
二、 填空题(共7小题,每空1分,共20分) 1.关于Raoult定律所讨论的依数性适用于______、______的______溶液。 2.反应 (a) C(s) + H2O(g) «CO(g) + H2(g) 及反应 (b) 3H2(g) + N2(g) « 2NH3(g)在密闭容器中进行,且呈平衡状态,当温度不变时,在上述反应中加入氮气以增加总压力,对反应(a)平衡将______移动,对反应(b)平衡将______移动。(填正向,逆向或不) 3. K3 [Fe(CN)6]的中心离子是______,配位数是______,配位原子是______,配体是______,配合物的命名是______。 4.已知下列反应均按正方向进行,在以下这些物质中,最强的氧化剂是______,最强的还原剂是______。 2FeCl3 + SnCl2 = 2FeCl2 + SnCl4 2KMnO4 + 10FeSO4 + 8H2SO4 = 2MnSO4 + 5Fe2(SO4)3 + K2SO4 + 8H2O 5.有下列几种物质:I-、NH3·H2O、CN- 和 S2-; (1) 当______存在时,Ag+ 的氧化能力最强; (2) 当______存在时,Ag的还原能力最强。 (Ksp(AgI) = 8.51 ´ 10-17,Ksp(Ag2S) = 6.69 ´ 10-50,K稳(Ag(NH3) K稳(Ag(CN) 6.在分光光度分析中,当空白溶液置入光路时,应使T = ______, A = ______。 7. NaHCO3和Na2CO3组成的缓冲溶液,抗酸成分是______,抗碱成分是______,该缓冲系的有效缓冲范围是______至______。(已知:H2CO3的pKa1=6.35,pKa2=10.33) 三、 单项选择题(选择正确答案的序号填入括号内)(共20小题,每小题2分,共40分) ( )1. 下列具有相同配位数的一组配合物是: A. [Co(en)3]Cl3 [Co(en)2(NO2)2] B. [Cu(H2O)2Cl2] [Ni(en)2(NO2)2] C. [Pt(NH3)2Cl2] [Pt(en)2Cl2]2+ D. 都不相同 ( )2. 已知313 K时,水的KW=3.8×10-14,此时c(H+)=1.0×10-7 mol·L-1的溶液是: A. 酸性 B. 中性 C. 碱性 D. 缓冲溶液 ( )3.某一有色溶液,测得其透光率为T。若将该溶液浓缩至其原来浓度的2倍,则在同样条件下,测得的透光率为: A. 2T B. T/2 C. T2 D. T1/2 ( )4. 环境对系统作10 kJ的功,且系统又从环境获得5 kJ的热量,系统内能变化是: A. +5 kJ B. +15 kJ C. -15 kJ D. -5 kJ ( )5. 下列配合物中属于弱电解质的是: A. [Ag(NH3)2]Cl B. K3[FeF6] C. [Co(en)3]Cl2 D. [PtCl2(NH3)2] ( )6. 二级反应速率常数的量纲是: A. s-1 B. mol·dm-3 C. mol·dm-3·s-1 D. mol-1·dm3·s-1 ( )7. 下列分子中属于极性分子的是: A. CCl4 B. CH3OCH3 C. BCl3 D. PCl5 ( )8.下列说法中,正确的是: A. 主量子数为1时,有自旋相反的两个轨道。 B. 主量子数为3时,3s、3p、3d共三个轨道。 C. 在除氢以外的原子中,2 p能级总是比2s能级高。 D. 电子云是电子出现的概率随r变化的图像。 ( )9. 以下哪种物质的熵值最高? A. 金刚石 B. Cl2(l) C. I2(g) D. Cu(s) ( )10. 在一个标准大气压,298 K时,反应O3 + NO A. 204.5 B. -204.5 C. 183.1 D. -183.1 ( )11. 改变速率常数k的因素是: A. 减少生成物浓度 B. 增加体系总压力 C. 增加反应物浓度 D. 升温和加入催化剂 ( )12. 下列反应中, A. C(s) + O2(g) B. 2SO2(g) + O2(g) C. CaSO4(s) + 2H2O(l) D. 3H2(g) + N2(g) ( )13.在0.1 mol·L-1 NaF溶液中: A. c(H+) ≈ c(HF) B. c(HF) ≈ c(OH-) C. c(H+) ≈ c(OH-) D. c(H+) ≈ c(HF) ( )14. 在铜锌原电池的铜半电池中加入氨水,则其电动势: A. 上升 B. 下降 C. 不变 D. 取决于具体浓度 ( )15. 下列各组原子轨道中不能叠加成键的是: A. px–px B. px–py C. s–px D. s–pz ( )16. 下列反应均在恒压下进行,若压缩容器体积,增加其总压力,平衡正向移动的是: A. CaCO3(s) B. H2(g) + Cl2(g) C. 2NO(g) + O2(g) D. COCl2(g) ( )17. 以下计算式答案 x 应为: 11.05+1.3153+1.225+25.0678 = x A. 38.6581 B. 38.64 D. 38.66 C. 38.67 ( )18. 与难挥发性非电解质稀溶液的蒸汽压降低、沸点升高、凝固点降低有关的因素为: A. 溶液的体积 B. 溶液的温度 C. 溶质的本性 D. 单位体积溶液中溶质质点数 ( )19. 对某NaOH溶液标定了四次,平均值为0.1258 mol·L-1, 其中三次的偏差为0.0004 mol·L-1, -0.0006 mol·L-1 , 0.0003 mol·L-1 。另一次的结果应为: A. 0.1259 mol·L-1 B. 0.1258 mol·L-1 C. 0.1257 mol·L-1 D. 0.1256 mol·L-1 ( )20. 将0.900 g某物质溶于60.0 g水中, 使溶液的凝固点降低了0.150 ℃, 该物质的相对分子质量是 (水的Kf = 1.86 K·kg·mol-1) : A. 204 B. 186 C. 83.2 D. 51.2 四.简答题(共4小题,每小题10分,共40分) 1. BF3是平面三角形的几何构型,但NF3却是三角锥形的几何构型,试用杂化轨道理论加以说明。 2. 用下列物质标定NaOH溶液浓度所得的浓度偏高、偏低还是准确?为什么? (1)部分风化的H2C2O4·H2O; (2)含有少量不溶性杂质(中性)的邻苯二甲酸氢钾。 3.硒与健康关系密切,硒在体内的活性形式为含硒酶和含硒蛋白。缺硒会引起克山病、大骨节病、白内障等。(1) 写出34号元素硒的核外电子排布式;(2) 写出硒在周期表中的位置;(3) 根据硒在周期表中的位置,推测硒的最高价氧化物。 4. 以下是3个需要酶催化的反应,若原始混合物中含有A、酶1和酶3,在不太长的时间内,体系中是否会有D存在?请解释理由。 (1) A (2) B (3) C 五.计算题(共4小题,每小题10分,共40分) 1. 已知Eθ(Cu2+/Cu)=0.340 V,Eθ(Ag+/Ag)=0.799 V,将铜片插入0.10 mol·L-1 CuSO4 溶液中,银片插入0.10 mol·L-1 AgNO3 溶液中组成原电池。 (1) 计算原电池的电动势。 (2) 写出电极反应、电池反应和原电池符号。 (3) 计算电池反应的平衡常数。 2. 某试样中含Na2CO3、NaHCO3和不与酸反应的杂质,称取该样品0.6839 g溶于水,用 0.2000 mol·L-1的HCl 溶液滴定至酚酞的红色褪去,用去HCl溶液23.10 mL。 加入甲 基橙指示剂后,继续用HCl 标准溶液滴定至由黄色变为橙色,又用去26.81 mL HCl溶 液。计算样品中两种主要成份的质量分数。 3. 3. 假设溶于水中的Mn(OH)2完全解离,试计算(已知:Ksp(Mn(OH)2) = 2.06×10-13): (1) Mn(OH)2在水中的溶解度(mol·L-1); (2) Mn(OH) 2饱和溶液中的[Mn2+]和[OH-]; (3) Mn(OH) 2在0.10 mol·L-1 NaOH溶液中的 溶解度(假设Mn(OH) 2在NaOH溶液中不发生其 它变化); (4) Mn(OH) 2在 0.20 mol·L-1MnCl2 溶液中的溶解度。 4. 已知下列反应在298.15 K,标准状态下: (1) Fe2O3(s) + 3CO(g) → 2Fe(s) + 3CO2(g); ΔrH (2) 3Fe2O3(s) + CO(g) → 2Fe3O4(s) + CO2(g);ΔrH (3) Fe3O4(s) + CO(g) → 3FeO(s) + CO2(g);ΔrH 试求(4) FeO(s) + CO(g) → Fe(s) + CO2(g)的Δr H |
B、材料科学基础
|
考生注意:所有答案必须写在答题纸(卷)上,写在本试题上一律不给分。 |
|
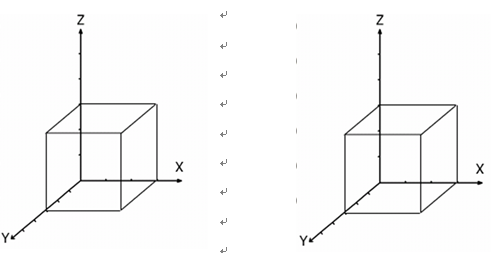
一、名词解释题(共10小题,每小题3分,共30分) 1、金属键; 2、空间点阵; 3、间隙固溶体; 4、肖特基空位; 5、交滑移; 6、动态再结晶; 7、过冷度; 8、共晶反应; 9、珠光体; 10、马氏体 二、选择题(可多选,共15小题,每小题3分,共45分) 1. 在MgO离子化合物中,最可能取代化合物中Mg2+的正离子(已知各正离子半径(nm)分别是:(Mg2+) 0.066、(Ca2+) 0.099、 (Li+) 0.066、(Fe2+)0.074)是 。 2. 简单立方晶体中原子的配位数为 。 (A) 12个 (B) 6个 (C) 8个 3. 按等径球体密堆积理论,最紧密的堆积形式是 。 (A) BCC (B) FCC (C) HCP 4. 在晶体中形成空位的同时又产生间隙原子,这样的缺陷称为 。 (A) 肖特基空位 (B) 弗兰克尔空位 (C) 线缺陷 5. 两根同号的螺位错(柏氏矢量分别为b1,b2),互相 。 6. 下列不可能是面心立方晶体的孪生面的是: 。 (A) (112) (B) (110) (C) (111) 7. 在菲克第一定律中,描述的稳态扩散是指质量浓度不随 而变化。 (A) 时间 (B) 距离 (C) 温度 8. 原子扩散的驱动力是 。 (A) 组元的浓度梯度 (B) 组元的化学势梯度 (C) 温度梯度 9. 柯肯达尔效应形成的原因是 。 (A) 锌和铜的扩散速率不同 (B) 钼丝在锌和铜中的扩散系数不同 (C) 锌和铜的扩散机制不同 10. 形成临界晶核时体积自由能的减少只能补偿表面能的 。 (A)1/3 (B)2/3 (C)3/4 11. 在固溶体液态凝固模型中,有效分配系数Ke表示了液相的混合程度,其取值范围是 (K0是平衡分配系数)。 (A) 1<Ke< K0 (B) K0 <Ke<1 (C) Ke< K0<1 12.包晶反应可以用 表示。 (A) L→L+A (B) L+A→B (C) C+A→B 13.铸铁和钢的本质区别在于组织中是否存在 。 (A) 莱氏体 (B) 渗碳体 (C) 珠光体 14.形成非晶态时相对容易的是 。 (A) 陶瓷 (B) 金属 (C) 聚合物 15. 铸件的宏观组织从外向里分别是 。 (A) 等轴晶区、柱状晶区、细晶区 (B) 柱状晶区、等轴晶区、细晶区 (C) 细晶区、柱状晶区、等轴晶区 三、画图题(共3小题,共20分) 1.在下图的正交点阵中画出:(11
(a)画晶面 (b)画晶向 2. 在下图的浓度三角形中: (1)写出点P、R的成分;(4分) (2)定出合金W(C)=80%,A,B组元浓度之比与S相同的合金成分点Y。(3分)
四、问答题(共3小题,每小题10分,共30分) 1. 材料常见的强化方式有哪些,其各自特点是什么?(10分) 2. 什么是固溶体,试论述影响置换固溶体溶解度的主要因素。(10分) 3. 什么是粗糙界面和光滑界面,它们对晶体生长方式和形态有何影响?(10分) 五、综合题(共1小题,共25分) 1) 画出铁碳合金平衡相图,并标出其中关键温度和成分,指出水平线上的反应,并根据铁碳相图回答下面问题。(11分) 2)计算含碳1.2%(质量分数)的铁碳合金在室温下各组织的相对含量。(9分) 3)有一含碳为2.2%(质量分数)的合金,观察到室温组织为珠光体和网状渗碳体,没有发现莱氏体,试分析原因。(5分)
|